Stereoizomeria (dawniej zwana izomerią optyczną) jest rodzajem izomerii konfiguracyjnej związanej z różnym rozmieszczeniem (położeniem) atomów lub grup atomów w przestrzeni, w określonych cząsteczkach. Do stereoizomerów należą min. enancjomery stanowiące parę: cząsteczka i jej lustrzane, nienakładane odbicie. Każdy atom węgla posiadający cztery różne podstawniki tworzy centrum stereogenne (asymetrii lub chiralności), dawniej takie atomy określano jako asymetryczne atomy węgla (nadmienić należy, że chiralność jest właściwością całej cząsteczki, natomiast stereogenność jest cechą strukturalną, która ją powoduje). Oznacza to, iż podstawniki przy tym atomie mogą zajmować różne pozycje w przestrzeni. Nałożenie lustrzanego dobicia cząsteczki zawierającej asymetryczny atom węgla na cząsteczkę pierwotną sprawia, że dwa spośród czterech podstawników zajmują inne pozycje w przestrzeni (mają inną konfigurację), nie nakładając się na siebie. Związki o tym samym wzorze strukturalnym mogą więc różnić się rozmieszczeniem przestrzennym podstawników przy asymetrycznym atomie węgla i są w istocie różnymi związkami (enancjomerami), mając jednocześnie identyczne właściwości chemiczne. Sytuacja ta ma istotne implikacje i w początkowym etapie rozwoju chemii organicznej jako dziedziny chemii rodziło pewne istotne problemy nomenklaturowe.
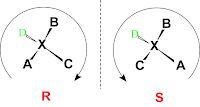
Istnienie tych różniących się związków (enancjomerów), jako pierwszy zaproponował Louis Pasteur, który podczas swoich badań nieoczekiwanie odkrył dwie enancjomorficzne formy krystaliczne soli kwasu winowego i wysnuł hipotezę istnienia izomerów, które różnią się między sobą tak, jak odbicia lustrzane tego samego przedmiotu. Wyniki swoich eksperymentów opublikował 1848 roku. W roku 1874 pionier termodynamiki chemicznej, Jacobus van’t Hoff, w oparciu o badania polarymetryczne wysnuł koncepcję istnienia, asymetrycznego atomu węgla, która pomogła wytłumaczyć istnienie izomerów, nie dającą się wytłumaczyć w oparciu o zwykły wzór strukturalny. Poniższy obrazek przestawia dwa enancjomery zawierające asymetryczny atom węgla (będący centrum stereogennym):
Metodę określania, a tym samym odróżniania poszczególnych izomerów zaproponował w roku 1885 pionier chemii cukrów Karl Fischer, za wzorzec przyjął aldehyd glicerynowy (wg poprawnego nazewnictwa IUPAC 2,3-dihydroksypropanal). Metoda ta polega na pionowym rzutowaniu wzoru strukturalnego cząsteczki na płaszczyznę wg schematu:
Metoda Fishera posiada istotne wady, otóż nie każdy związek chemiczny można porównać do aldehydu glicerynowego, stąd wynika jej ograniczenie głównie do związków zawierających grupę hydroksylową. Metoda ma również tą wadę, że pozwala obracać rzutowany wzór strukturalny cząsteczki jedynie o 180° wokół osi prostopadłej do płaszczyzny rzutowania obrócenie go o 90° lub 270° wokół tej samej osi prowadzi do otrzymania wzoru drugiego enancjomeru. Powyższa reguła (nazwana projekcją Fishera) jest metodą względną, co oznacza, że nie pozwala na rzeczywiste określenie konfiguracji przestrzennej podstawników centra stereogennego (enancjomerów).
Udoskonaloną metodę określania konfiguracji przestrzennej podstawników centra stereogennego wprowadzili w latach 50-tych XX wieku pionierzy stereochemii Cahn, Ingold i Prelog i jest ona metodą bezwzględną (absolutną). Ustalanie konfiguracji wg reguły CIP (nazwanej od nazwiska jej twórców) wokół danego centrum stereogennego przeprowadza się zgodnie z następującymi regułami:
Określanie względne konfiguracji przestrzennej można wykonywać za pomocą spektroskopii 1H NMR, poprzez pomiar stałych sprzężenia jąder atomów wodoru, za pomocą spektroskopii NOSY (wykorzystującą jądrowy efekt Overhausera - NOE) oraz za pomocą spektroskopii dichroizmu kołowego.
Nie ma żadnej korelacji między metodami określania konfiguracji D–L oraz R–S. Oznacza to, że konfiguracja D, określona przy pomocy wzoru Fischera, wcale nie musi odpowiadać konfiguracji R, określonej za pomocą reguły CIP i odwrotnie. Jednakże w wielu, zwłaszcza prostych, przypadkach występuje zgodność obu metod. Obecnie reguła CIP jest jedyną poprawną metodą określania konfiguracji przestrzennej związków zawierających centra stereogenne, nie mniej jednak metoda Fischera nadal jest dość popularna, szczególnie w stereochemii cukrów i białek (w tym aminokwasów), co niestety często niesie ze sobą wiele nieścisłości.
Zależność pomiędzy stereoizomerami zawierającymi dwa centra stereogenne (dwa asymetryczne atomy węgla) przedstawia się następująco:
Poruszając zagadnienia stereochemii (głównie konfiguracji przestrzennej) nie sposób omówić tematu skręcalności właściwej (optycznej), która bardzo często mylona jest z konfiguracją przestrzenną (zarówno dla projekcji Fishera jak i metody CIP). Nadmienić od razu należy, że są to różne własności, w żaden sposób ze sobą nie korelujące, aczkolwiek skręcalność optyczna wynika z obecności jednego lub więcej centrów stereogennych o określonej konfiguracji przestrzennej (zakładając, że każde z nich zawiera rożne podstawniki przy asymetrycznych atomach węgla). Skręcalność właściwa jest to zdolność substancji do skręcania płaszczyzny światła spolaryzowanego o pewien kąt. W przypadku substancji stałych bada się ich roztwory. Metody pomiaru skręcalności właściwej nazywa się polarymetrią.
Technicznie badanie polarymetryczne wykonuje się przepuszczając światło spolaryzowane, o określonej długości fali, przez szklaną tubę o zdefiniowanej długości, zawierającą przezroczystą substancję badaną (lub jej przezroczysty roztwór w przypadku substancji stałych o zdefiniowanym stężeniu) i pomiarze kąta skręcania płaszczyzny tego światła po przejściu przez tubę. W przypadku substancji polarnych (rozpuszczalnych w wodzie) wykonuje się pomiary roztworów wodnych, zazwyczaj dla linii D sodu o długości fali 589 nm, czyli z zakresu światła widzialnego, w temperaturze 293.15 K. Kąt skręcania płaszczyzny światła spolaryzowanego, w przypadku roztworów, zależy od substancji badanej, stężenia jej roztworu, rozpuszczalnika, długości fali, temperatury oraz długości szklanej tuby. Wartość kąta może przyjmować zarówno wartości dodatnie jak i ujemne. Skręcanie płaszczyzny światła przez substancję w stronę prawą oznacza się (+), w stronę lewą minus (-), dla tej pierwszej wartość kąta jest dodatnia, dla drugiej ujemna. O takich związkach mówi się potocznie, że są, kolejno, prawoskrętne i lewoskrętne. Tak jak to zostało napisane wcześniej, konfiguracja przestrzenna (zarówno w metodzie Fishera jak i CIP) oraz skręcalność właściwa (optyczna) są to różnymi właściwościami substancji, w żaden sposób ze sobą nie korelujące, tak więc istnieć mogą związki o konfiguracji R i skręcalności właściwej (+) oraz analogicznie S i (-), jak i związki o konfiguracji R i skręcalności właściwej (-), analogicznie S i (+). Przykładami takich związków są kolejno: kwas (+)-(S)-2-hydroksypropanowy i kwas (-)-(R)-2-hydroksypropanowy, czyli kwas mlekowy oraz, odwrotnie, (+)-R-2,3-dihydroksypropanal i (-)-S-2,3-dihydroksypropanal czyli aldehyd glicerynowy.
Za pomocą metod polarymetrycznych można wyznaczać stężenia substancji w roztworze, czystość izomerów oraz badać kinetykę reakcji chemicznych. Poniższy rysunek przedstawia schemat badania polarymetrycznego:
Stereochemia kwasu askorbowego (witaminy C)
Kwas askorbowy zwyczajowo nazywany witaminą C, jest niezbędnym, egzogennym składnikiem pokarmowym, pełniącym bardzo wiele funkcji fizjologicznych w organizmie człowieka, min. utrzymuje odpowiedni potencjał oksydoredukcyjny, poprzez uczestnictwo w neutralizowaniu reaktywnych form tlenu i azotu (tzw. wolnych rodników), chroniąc makrocząsteczki komórki przed powstawaniem uszkodzeń oksydacyjnych. Protekcyjne działanie witaminy C wobec DNA jest związane nie tylko z jej udziałem w reakcjach wolnorodnikowych, ale również z jej wpływem na ekspresję genów uczestniczących w procesach apoptozy i reperacji DNA.
Kwas askorbowy jest organicznym związkiem chemicznym z grupy nienasyconych alkoholi polihydroksylowych. Jego cząsteczka składa się z jednonienasyconego pierścienia γ-butyrolaktonowego z przyłączonymi dwoma grupami hydroksylowymi i przyłączonego do niego łańcucha bocznego, który również zawiera dwie grupy hydroksylowe. Poprawna nazwa biologicznie aktywnego kwasu askorbowego (wg IUPAC) to (2R)-2-[(1S)-1,2-dihydroksyetylo]-3,4-dihydroksy-2H-furan-5-on. Poniższy obrazek przedstawia wzór strukturalny kwasu askorbowego, stereoizomeru biologicznie aktywnego (uwzględniający konfigurację centrów stereogennych - przy kreskowanych wiązaniach):
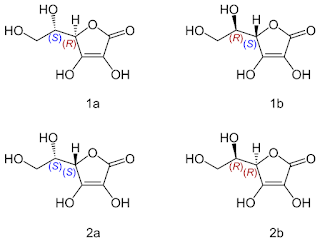
Kwas askorbowy, jest cząsteczką optycznie czynną, co warunkowane jest obecnością w dwóch centrów stereogennych (asymetryczny atomów węgla) w jego cząsteczce, w pozycji 2 pierścienia heterocyklicznego i również drugiej łańcucha bocznego. Oznacza to, że do każdego z tych dwóch atomów węgla przyłączone są cztery różne podstawniki. Hybrydyzacja asymetrycznych atomów węgla jest więc hybrydyzacją sp3. Zgodnie z regułą Le Bela-van't Hoffa cząsteczka kwasu askorbowego posiada 2n stereoizomerów, gdzie n oznacza liczbę centrów stereogennych, w tym przypadku wynosi ona 4. Poniższy obrazek przedstawia jego 4 stereoizomery:
Tylko pierwszy z nich, oznaczony 1a na obrazku, jest biologicznie aktywnym stereoizomerem pełniącym wymienione wcześniej funkcje biologiczne (wykazuje tzw. działanie witaminizujące), jego nazwa chemiczna to: (2R)-2-[(1S)-1,2-dihydroksyetylo]-3,4-dihydroksy-2H-furan-5-on i tylko ten związek nazywany jest zwyczajowo witaminą C. Z powyższej nazwy wynika, że asymetryczny atom węgla w łańcuchu bocznym ma konfigurację S, natomiast w pierścieniu konfigurację R. Powyższa, dość trudna, nazwa jest istotna, ponieważ jednoznacznie określa, konfigurację obydwu centrów stereogennych cząsteczki, a tym samym definiuje, że jest to biologicznie aktywny stereoizomer. Pozostałe związki mimo, że również mogą pełnić w organizmie funkcje przeciwutleniaczy, to geometrycznie nie pasują do naszych enzymów, analogicznie do poniższego rysunku:
Producenci leków i suplementów diety zawierających witaminę C (czyli stereoizomer biologicznie aktywny) na ulotkach i/lub na opakowaniach umieszczają informację, że produkt zawiera kwas L-askorbinowy. Jawi się tutaj bardzo duża nieścisłość, bo nie dość, że nazwa kwas askorbinowy jest niepoprawna (właściwa to kwas askorbowy), to zawiera ona określenie konfiguracji przestrzennej w przestarzałej projekcji Fishera nie definiując, którego z dwóch centrów stereogenych (asymetrycznego atomu węgla) ona dotyczy. Dlatego określenie biologicznie aktywnego stereoizomeru wymaga podania pełnej nazwy cząsteczki, która to jednoznacznie definiuje konfigurację przestrzenną na każdym z dwóch centrów stereogennych. Sama nazwa kwas L-askorbinowy mimo iż niepoprawna, jest potoczną (zwyczajową) jego nazwą biologicznie aktywnego kwasu askorbowego. Mimo tych niejednoznaczności każdy dostępny lek bądź suplement diety zawiera aktywny biologicznie stereoizomer kwasu askorbowego. Jeżeli byłoby inaczej producent musiałby umieścić stosowną informację. W przemyśle spożywczym witamina C, czyli biologicznie aktywny izomer posiada symbol E300. Nazwy potoczne poszczególnych stereoizomerów, biologicznie nieaktywnych, to: kwas D-askorbowy (1b na rysunku), kwas L-izoaskorbowy (2a na rysunku) i kwas D-izoaskorowy (2b na rysunku) o potocznej nazwie kwas erytrobowy (i symbolu E315) i są one biologicznie nieaktywne.
Jeśli chodzi o skręcalność właściwą biologicznie aktywnego stereoizomeru kwasu askorbowego (czyli o konfiguracji S dla asymetrycznego atomu węgla w łańcuchu, i R dla pierścienia), to jego roztwór wodny o stężeniu 1 mol/dm3 w temperaturze 298.15 K, dla linii sodowej D skręca płaszczyznę polaryzacji w prawo, a wartość kąta, w stopniach, wynosi od +20.5 do +21.5. Tak więc witamina C (czyli biologicznie aktywny stereoizomer kwasu askorbowego) jest prawoskrętny - (+). Pojęcie skręcalności właściwej traci całkowicie na znaczeniu w przypadku postaci innej niż roztwór (witaminy C), czyli w formie proszku bądź tabletek, ponieważ jest ona substancją nieprzezroczystą, barwy białej i tym samym nie jest możliwe wykonanie dla niej pomiaru polarymetrycznego.
Niestety i w kwestii skręcalności właściwej producenci leków i suplementów diety zawierających witaminę C mylą konfigurację przestrzenną L (wg projekcji Fishera) w jej niepoprawnej nazwie (kwas L-askorbinowy), ze skręcalnością właściwą, umieszczając na opakowaniach preparatów informację "witamina C lewoskrętna" lub "kwas L-askorbinowy lewoskrętny". Powoduje to nie lada chaos wśród konsumentów poszukujących tylko biologicznie aktywnego stereoizomeru. Istotne jest również to, że naturalnie występująca witamina C jest chemicznie (i strukturalnie) identyczna z witaminą C syntetyczną, czyli jest tym samym biologicznie aktywnym stereoizomerem. Reasumując można postawić znak równości pomiędzy nazwami tego samego związku:
witamina C = biologicznie aktywny stereoizomer = kwas askorbowy = kwas (+)-L-askorbinowy (roztwór wodny) = prawoskrętny (roztwór wodny) = syntetyczny = naturalny
Istnienie tych różniących się związków (enancjomerów), jako pierwszy zaproponował Louis Pasteur, który podczas swoich badań nieoczekiwanie odkrył dwie enancjomorficzne formy krystaliczne soli kwasu winowego i wysnuł hipotezę istnienia izomerów, które różnią się między sobą tak, jak odbicia lustrzane tego samego przedmiotu. Wyniki swoich eksperymentów opublikował 1848 roku. W roku 1874 pionier termodynamiki chemicznej, Jacobus van’t Hoff, w oparciu o badania polarymetryczne wysnuł koncepcję istnienia, asymetrycznego atomu węgla, która pomogła wytłumaczyć istnienie izomerów, nie dającą się wytłumaczyć w oparciu o zwykły wzór strukturalny. Poniższy obrazek przestawia dwa enancjomery zawierające asymetryczny atom węgla (będący centrum stereogennym):
Metodę określania, a tym samym odróżniania poszczególnych izomerów zaproponował w roku 1885 pionier chemii cukrów Karl Fischer, za wzorzec przyjął aldehyd glicerynowy (wg poprawnego nazewnictwa IUPAC 2,3-dihydroksypropanal). Metoda ta polega na pionowym rzutowaniu wzoru strukturalnego cząsteczki na płaszczyznę wg schematu:
czyli:
- pionowo do płaszczyzny rzutowania
- atom centralny znajduje się w płaszczyźnie papieru
- atomy leżące powyżej i poniżej atomu centralnego znajdują się pod płaszczyzną papieru
- atomy leżące z lewej i z prawej strony atomu centralnego znajdują się nad płaszczyzną papieru
- atom o najniższym lokancie wg. liczby atomowej (Z) znajduje się u góry
Udoskonaloną metodę określania konfiguracji przestrzennej podstawników centra stereogennego wprowadzili w latach 50-tych XX wieku pionierzy stereochemii Cahn, Ingold i Prelog i jest ona metodą bezwzględną (absolutną). Ustalanie konfiguracji wg reguły CIP (nazwanej od nazwiska jej twórców) wokół danego centrum stereogennego przeprowadza się zgodnie z następującymi regułami:
- kolejności pierwszeństwa podstawników atomu stanowiącego centrum chiralności
- podstawnik o najniższym pierwszeństwie (D na obrazku poniżej) musi znajdować się najdalej od obserwatora
- jeśli układ pozostałych podstawników jest taki, że patrząc od strony obserwatora należy wodzić okiem od podstawnika o największym pierwszeństwie (A) do trzeciego w kolejności (C) zgodnie z kierunkiem wskazówek zegara to konfiguracja absolutna jest oznaczana literą R (z łac. rectus - prawy), a gdy odwrotnie literą S (z łac. sinister - lewy)
W ramach reguły (konwencji) Cahna-Ingolda-Preloga istnieją następujące reguły ustalania pierwszeństwa:
- w pierwszej kolejności jest to liczba atomowa (Z) atomu podstawnika, który jest bezpośrednio przyłączony do centrum chiralności, jeżeli podstawnikiem jest wolna para elektronowa, to przypisuje się jej Z = 0
- w wypadku występowania izotopów, o pierwszeństwie decyduje ich większa liczba masowa (A)
- jeśli podstawniki łączą się z centrum chiralności atomami tego samego pierwiastka, to bierze się pod uwagę kolejne atomy przyłączone bezpośrednio do atomu, którym cały podstawnik łączy się z centrum chiralności, jeśli i te mają tę samą liczbę atomową, należy wziąć pod uwagę kolejne itd.
- jeśli dalsze atomy są połączone wiązaniami wielokrotnymi, liczy się je jakby były połączone wiązaniami pojedynczymi, tyle że wiele razy, przykładowo, podstawnik –A=B będzie pierwszy, gdyż A łączy się z atomem B "dwukrotnie", podczas gdy podstawnik –A–B tylko "jednokrotnie"
- jeśli podstawniki różnią się jedynie konfiguracją absolutną na centrach stereogenicznych pierwszeństwo przypisuje się podstawnikowi o konfiguracji R
Określanie względne konfiguracji przestrzennej można wykonywać za pomocą spektroskopii 1H NMR, poprzez pomiar stałych sprzężenia jąder atomów wodoru, za pomocą spektroskopii NOSY (wykorzystującą jądrowy efekt Overhausera - NOE) oraz za pomocą spektroskopii dichroizmu kołowego.
Nie ma żadnej korelacji między metodami określania konfiguracji D–L oraz R–S. Oznacza to, że konfiguracja D, określona przy pomocy wzoru Fischera, wcale nie musi odpowiadać konfiguracji R, określonej za pomocą reguły CIP i odwrotnie. Jednakże w wielu, zwłaszcza prostych, przypadkach występuje zgodność obu metod. Obecnie reguła CIP jest jedyną poprawną metodą określania konfiguracji przestrzennej związków zawierających centra stereogenne, nie mniej jednak metoda Fischera nadal jest dość popularna, szczególnie w stereochemii cukrów i białek (w tym aminokwasów), co niestety często niesie ze sobą wiele nieścisłości.
Zależność pomiędzy stereoizomerami zawierającymi dwa centra stereogenne (dwa asymetryczne atomy węgla) przedstawia się następująco:
Technicznie badanie polarymetryczne wykonuje się przepuszczając światło spolaryzowane, o określonej długości fali, przez szklaną tubę o zdefiniowanej długości, zawierającą przezroczystą substancję badaną (lub jej przezroczysty roztwór w przypadku substancji stałych o zdefiniowanym stężeniu) i pomiarze kąta skręcania płaszczyzny tego światła po przejściu przez tubę. W przypadku substancji polarnych (rozpuszczalnych w wodzie) wykonuje się pomiary roztworów wodnych, zazwyczaj dla linii D sodu o długości fali 589 nm, czyli z zakresu światła widzialnego, w temperaturze 293.15 K. Kąt skręcania płaszczyzny światła spolaryzowanego, w przypadku roztworów, zależy od substancji badanej, stężenia jej roztworu, rozpuszczalnika, długości fali, temperatury oraz długości szklanej tuby. Wartość kąta może przyjmować zarówno wartości dodatnie jak i ujemne. Skręcanie płaszczyzny światła przez substancję w stronę prawą oznacza się (+), w stronę lewą minus (-), dla tej pierwszej wartość kąta jest dodatnia, dla drugiej ujemna. O takich związkach mówi się potocznie, że są, kolejno, prawoskrętne i lewoskrętne. Tak jak to zostało napisane wcześniej, konfiguracja przestrzenna (zarówno w metodzie Fishera jak i CIP) oraz skręcalność właściwa (optyczna) są to różnymi właściwościami substancji, w żaden sposób ze sobą nie korelujące, tak więc istnieć mogą związki o konfiguracji R i skręcalności właściwej (+) oraz analogicznie S i (-), jak i związki o konfiguracji R i skręcalności właściwej (-), analogicznie S i (+). Przykładami takich związków są kolejno: kwas (+)-(S)-2-hydroksypropanowy i kwas (-)-(R)-2-hydroksypropanowy, czyli kwas mlekowy oraz, odwrotnie, (+)-R-2,3-dihydroksypropanal i (-)-S-2,3-dihydroksypropanal czyli aldehyd glicerynowy.
Za pomocą metod polarymetrycznych można wyznaczać stężenia substancji w roztworze, czystość izomerów oraz badać kinetykę reakcji chemicznych. Poniższy rysunek przedstawia schemat badania polarymetrycznego:
Stereochemia kwasu askorbowego (witaminy C)
Kwas askorbowy zwyczajowo nazywany witaminą C, jest niezbędnym, egzogennym składnikiem pokarmowym, pełniącym bardzo wiele funkcji fizjologicznych w organizmie człowieka, min. utrzymuje odpowiedni potencjał oksydoredukcyjny, poprzez uczestnictwo w neutralizowaniu reaktywnych form tlenu i azotu (tzw. wolnych rodników), chroniąc makrocząsteczki komórki przed powstawaniem uszkodzeń oksydacyjnych. Protekcyjne działanie witaminy C wobec DNA jest związane nie tylko z jej udziałem w reakcjach wolnorodnikowych, ale również z jej wpływem na ekspresję genów uczestniczących w procesach apoptozy i reperacji DNA.
Kwas askorbowy jest organicznym związkiem chemicznym z grupy nienasyconych alkoholi polihydroksylowych. Jego cząsteczka składa się z jednonienasyconego pierścienia γ-butyrolaktonowego z przyłączonymi dwoma grupami hydroksylowymi i przyłączonego do niego łańcucha bocznego, który również zawiera dwie grupy hydroksylowe. Poprawna nazwa biologicznie aktywnego kwasu askorbowego (wg IUPAC) to (2R)-2-[(1S)-1,2-dihydroksyetylo]-3,4-dihydroksy-2H-furan-5-on. Poniższy obrazek przedstawia wzór strukturalny kwasu askorbowego, stereoizomeru biologicznie aktywnego (uwzględniający konfigurację centrów stereogennych - przy kreskowanych wiązaniach):
Jeśli chodzi o skręcalność właściwą biologicznie aktywnego stereoizomeru kwasu askorbowego (czyli o konfiguracji S dla asymetrycznego atomu węgla w łańcuchu, i R dla pierścienia), to jego roztwór wodny o stężeniu 1 mol/dm3 w temperaturze 298.15 K, dla linii sodowej D skręca płaszczyznę polaryzacji w prawo, a wartość kąta, w stopniach, wynosi od +20.5 do +21.5. Tak więc witamina C (czyli biologicznie aktywny stereoizomer kwasu askorbowego) jest prawoskrętny - (+). Pojęcie skręcalności właściwej traci całkowicie na znaczeniu w przypadku postaci innej niż roztwór (witaminy C), czyli w formie proszku bądź tabletek, ponieważ jest ona substancją nieprzezroczystą, barwy białej i tym samym nie jest możliwe wykonanie dla niej pomiaru polarymetrycznego.
Niestety i w kwestii skręcalności właściwej producenci leków i suplementów diety zawierających witaminę C mylą konfigurację przestrzenną L (wg projekcji Fishera) w jej niepoprawnej nazwie (kwas L-askorbinowy), ze skręcalnością właściwą, umieszczając na opakowaniach preparatów informację "witamina C lewoskrętna" lub "kwas L-askorbinowy lewoskrętny". Powoduje to nie lada chaos wśród konsumentów poszukujących tylko biologicznie aktywnego stereoizomeru. Istotne jest również to, że naturalnie występująca witamina C jest chemicznie (i strukturalnie) identyczna z witaminą C syntetyczną, czyli jest tym samym biologicznie aktywnym stereoizomerem. Reasumując można postawić znak równości pomiędzy nazwami tego samego związku:
witamina C = biologicznie aktywny stereoizomer = kwas askorbowy = kwas (+)-L-askorbinowy (roztwór wodny) = prawoskrętny (roztwór wodny) = syntetyczny = naturalny
Literatura:
https://pubchem.ncbi.nlm.nih.gov/compound/ascorbic_acid#section=Names-and-Identifiers
http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.607.7841&rep=rep1&type=pdf
http://www.anme.com.mx/libros/Vitamin%20C%20Its%20Chemistry%20and%20Biochemistry.pdf
http://krzysztofrebilas.republika.pl/Gotowe/cw-45.pdf
http://www.ochempal.org/index.php/alphabetical/e-f/fischer-projection/
http://www.ochempal.org/index.php/alphabetical/q-r/rs-convention/
www.phmd.pl/fulltxt.php?ICID=12246
http://agro.icm.edu.pl/agro/element/bwmeta1.element.agro-article-8c0c0a23-0f99-4d34-b2c1-c118363dde0c/c/01_Grajek-1.pdf
http://dergiler.ankara.edu.tr/dergiler/24/1716/18327.pdf
http://www.pharm.auth.gr/kanellis/pub/25.pdf
http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.529.7411&rep=rep1&type=pdf
http://www.efsa.europa.eu/sites/default/files/scientific_output/files/main_documents/4087.pdf
https://pubchem.ncbi.nlm.nih.gov/compound/ascorbic_acid#section=Names-and-Identifiers
http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.607.7841&rep=rep1&type=pdf
http://www.anme.com.mx/libros/Vitamin%20C%20Its%20Chemistry%20and%20Biochemistry.pdf
http://krzysztofrebilas.republika.pl/Gotowe/cw-45.pdf
http://www.ochempal.org/index.php/alphabetical/e-f/fischer-projection/
http://www.ochempal.org/index.php/alphabetical/q-r/rs-convention/
www.phmd.pl/fulltxt.php?ICID=12246
http://agro.icm.edu.pl/agro/element/bwmeta1.element.agro-article-8c0c0a23-0f99-4d34-b2c1-c118363dde0c/c/01_Grajek-1.pdf
http://dergiler.ankara.edu.tr/dergiler/24/1716/18327.pdf
http://www.pharm.auth.gr/kanellis/pub/25.pdf
http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.529.7411&rep=rep1&type=pdf
http://www.efsa.europa.eu/sites/default/files/scientific_output/files/main_documents/4087.pdf